4月18日,《科学》杂志在线发布了中国工程院院士、第二军医大学医学免疫学国家重点实验室主任曹雪涛课题组关于lncRNA在树突状细胞分化发育与功能调控方面的研究论文。在这篇论文中,研究者鉴定出一个在树突状细胞(DC)特异表达的lncRNA:lnc-DC,并发现了一种新的lncRNA作用模式。
本文中,研究者首先使用转录组芯片与RNA测序,在人外周血单核细胞诱导分化的DC(Mo-DC)中鉴别出特异性表达的lncRNA,使用qPCR对芯片与测序结果验证,也发现在免疫细胞群中,该lncRNA只在DC中特异表达,被命名为lnc-DC。
为了解释lnc-DC在DC中的特异表达,研究者先对DC分化中与促进转录相关的表观遗传作用进行了研究,使用ChIP-Seq及多位点ChIP-qPCR这些技术手段,发现lnc-DC基因座附近两个正向调节转录丰度的组蛋白修饰富集,lnc-DC转录起始位点附近核染色质结构较为疏松,且DC分化的关键调节因子PU.1会同lnc-DC启动子区域结合,这些因素共同促进DC中lnc-DC的特异表达。
在获取了lnc-DC表达调控信息后,作者希望进一步了解lnc-DC在DC分化中的角色,并阐明其中分子机制。首先以慢病毒为载体在人DC中对lnc-DC沉默,使用转录组芯片分析发现,DC中很多基因表达量变化,600多个编码基因上调,而DC功能相关基因却出现了下调。使用流式细胞术分析lnc-DC沉默后DC蛋白表达发现DC中多种对激活T细胞非常重要的蛋白出现下调,而单核细胞标记却出现上调,这些变化会损坏Mo-DC抗原摄入及T细胞增殖能力,进一步发现,在鼠骨髓细胞内沉默lnc-DC直系同源基因也会破坏鼠DC分化。这些结果,说明lnc-DC的缺失会改变DC分化趋势,影响DC功能。
在探讨lnc-DC实现其调控DC分化的功能分子机制时,研究者首先通过qPCR及泊松分布分析,确定lnc-DC对邻近基因没有影响,首先排除lnc-DC通过影响邻近基因产生作用的可能。因为在已报道的研究中,定位于细胞核内的lncRNA通过与细胞核中的异核蛋白或染色质修饰复合体发挥作用,而定位于胞质内的lncRNA则有两种作用机制,或作为竞争性内生RNA隔离microRNA来恢复mRNA翻译,或通过一个ALU元件,促进由STAU1介导的mRNA衰减来。本文研究者首先通过RNA FISH和逆转录PCR首先定位lnc-DC,结果显示lnc-DC定位于胞质内。后续的RIP显示,lnc-DC既没有与包含miRNA的RISC复合物的关键元件AGO2结合,也不会ALU元件结合,它并非通过以上两种胞内机制发挥作用,或许存在于另一种新的作用模式,可能是通过结合其他蛋白产生作用。
接下来的实验,证明了研究者这个假设,使用生物素化lnc-DC进行体外蛋白质结合实验及质谱分析后,一种调控DC分化的转录因子STAT3,被鉴别为lnc-DC的集合蛋白,RNA FISH也进一步显示lnc-DC对胞质中的STAT3有调控作用。通过lnc-DC突变体与STAT3的RIP实验,确定lnc-DC的3’端与STAT3结合,而通过携带不同标记的STAT3与lnc-DC的3’端RIP实验,也发现STAT3羧基端与lnc-DC的3’端相互作用。由于STAT3羧基端这片区域内Y705位点的磷酸化状态对STAT3激活和核转运非常重要,研究者又对lnc-DC是否会对Y705磷酸化状态产生影响进行了研究,通过免疫印迹、核内外免疫荧光检测及磷酸化分析,发现lnc-DC会阻止磷酸酶SHP1与STAT3的结合,保护Y705磷酸化状态,增强DC中的STAT3信号通路,以此实现其维持与促进人DC发育成熟和激活T细胞免疫应答的能力,最终对DC分化发育、抗原递呈与免疫激活功能起到至关重要的作用。

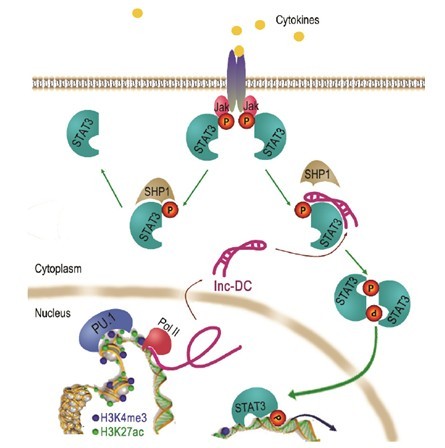
本文中,曹雪涛课题组在鉴定出一种DC中专一表达的lncRNA的同时,也发现了一种新的lncRNA作用模式,这对lncRNA未来研究方向的扩展非常重要(图 2)。同时,曹雪涛课题组所建立的“以转录组芯片与测序大规模筛选为基础,结合qPCR、Chip-Seq、RIP、免疫印迹等研究手段进行验证(图 1)”的研究策略,也为其他lncRNA研究者提供了参考。锐博生物凭借经验丰富的团队、领先可靠的设备平台,为研究者提供包括lncRNA深度测序、表达谱芯片、qPCR、Chip-Seq等全方位的lncRNA技术服务及完善的实验解决方案,加速研究者科研进程,帮助研究者发现更多lncRNA未知功能。
The STAT3-Binding Long Noncoding RNA lnc-DC Controls Human Dendritic Cell Differentiation
Long noncoding RNAs (lncRNAs) play important roles in diverse biological processes; however,few have been identified that regulate immune cell differentiation and function. Here, we identified lnc-DC, which was exclusively expressed in human conventional dendritic cells (DCs). Knockdown of lnc-DC impaired DC differentiation from human monocytes in vitro and from mouse bone marrow cells in vivo and reduced capacity of DCs to stimulate T cell activation. lnc-DC mediated these effects by activating the transcription factor STAT3 (signal transducer and activator of transcription 3). lnc-DC bound directly to STAT3 in the cytoplasm, which promoted STAT3 phosphorylation on tyrosine-705 by preventing STAT3 binding to and dephosphorylation by SHP1. Our work identifies a lncRNA that regulates DC differentiation and also broadens the known mechanisms of lncRNA action.
